A Covax Facility é uma coalizão de mais de 150 países liderada pela OMS para impulsionar o desenvolvimento e a distribuição das vacinas.
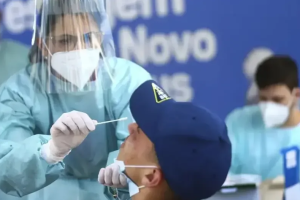
A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu nesta terça-feira (9) que vacinas compradas pelo Ministério da Saúde por meio da Covax Facility estão dispensadas da exigência de registro e de autorização temporária de uso emergencial.
A Covax Facility é uma coalizão de mais de 150 países criada para impulsionar o desenvolvimento e a distribuição das vacinas contra a Covid-19. A iniciativa é liderada pela Organização Mundial de Saúde (OMS).
O Brasil deve receber 10,6 milhões de doses de vacinas pela Covax no primeiro semestre. O acordo do país com a OMS para receber um total de 42 milhões de doses vai custar R$ 2,5 bilhões.
Impasse sobre novos pedidos
A decisão da diretoria colegiada da Anvisa resolve um possível impasse: a Anvisa havia afirmado que mesmo a vacina de Oxford, já aprovada para uso emergencial no país, teria a necessidade de um novo pedido de registro dependendo do local de produção e da forma de apresentação das doses que serão enviadas pela Covax.
O registro emergencial já concedido analisou vacinas de Oxford produzidas e finalizadas pelo laboratório Serum, da Índia. Se houvesse mudança de fornecedor, haveria necessidade de outro pedido de uso. Com a decisão mais recente da Anvisa, um novo pedido não será mais necessário para a vacina de Oxford ou mesmo para outra vacina que seja futuramente enviada pela aliança.
Doses previstas para o Brasil e o mundo
Em outubro, o secretário-executivo do Ministério da Saúde, Élcio Franco, informou que a contribuição do Brasil na aliança global previa, como contrapartida, o recebimento de 42 milhões de doses de vacinas.
Esse total seria suficiente para a cobertura de 10% da população brasileira, o que equivale a cerca de 21 milhões de pessoas (considerando a necessidade de dose dupla).
A aliança Covax vai disponibilizar ao menos 2 bilhões de doses de vacinas até o fim de 2021 e 92 países pobres deverão ter acesso a 1,3 bilhão de doses ainda no primeiro semestre. O Brasil participa da aliança, mas não está na lista dos países mais pobres.
Por G1















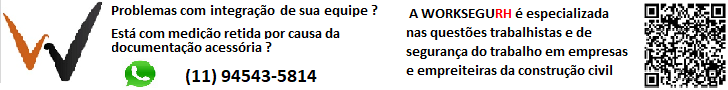



























































Adicionar comentário